Av: Ragnhild Sofie Ragnhildstveit Sætra og Sindre Ullmann, stipendiater ved CEMIR, Institutt for klinisk og molekylær medisin, NTNU
Tverrfagleg tilnærming avdukar ny rolle for tuberkelbakteriens evne til å skade membranar i vertsceller

Slik ser arbeid inne på biosikkerheitsnivå 3-labben ut. Foto: Ragnhild Sætra/NTNU
Sjukdommen tuberkulose har i liten grad vore grunn for uro i Noreg heilt sida foreldra våre var barn; ein må med andre ord tilbake til 1950-talet. I tida etter andre verdskrig gjorde antibiotika sitt inntog i kampen mot tuberkelbakterien. Dødelegheita frå tuberkulose i Noreg sank til nær null på 1950-talet, og den har heldt seg stabilt låg sida. Allereie i denne tida såg ein framvekst av antibiotikaresistente stammar av Mycobacterium tuberculosis, men nye antibiotika vart oppdaga med slik hyppigheit at ein har vore i stand til å handtere resistente tuberkelbakteriar etter kvart som dei har presentert seg.
Dette biletet har endra seg dramatisk den siste tida. Eit viktig bidrag til denne endringa er at talet på nye godkjente antibiotikamedisinar var på sitt høgaste på 80-talet. Sida årtusenskiftet har talet på nye antibiotika falle til eit lågare nivå enn kva ein såg på 1930-talet, det fyrste tiåret med antibiotika. Dei siste ti åra har det kome rapportar frå fleire stader i verda om tuberkelbakteriar som er resistente mot alle kjente antibiotika.
Eit styrka immunforsvar mot tuberkelbakterien
Ny kunnskap vil vere avgjerande dersom me skal sigre i kampen mot vondsinna bakteriar når antibiotikaresistens aukar. Ei større forståing av interaksjonane mellom vertscella og tuberkelbakterien kan mogleggjere utvikling av nye metodar innan behandling, diagnose og vaksiner. Kan me utvikle medisinar som styrker immunforsvaret vårt, i motsetning til å berre svekkje bakterien slik antibiotika gjer?
Immuncellene våre fagosyterer – «spiser» – uvelkomne bakteriar for å drepe dei, men tuberkelbakterien kan øydelegge membranen den vert pakka inn i. Vertscellene prøver å motvirke dette ved å reparere skadde membranar. I tillegg forsøker cella å reisolere bakteriar som bryt seg ut ved hjelp av autofagi – «sjølvspising» – slik at bakterien kan destruerast i eit avgrensa og kontrollert miljø. Når immunceller vert infisert av tuberkelbakteriar og døyr kan bakteriane spreie seg og skape større skade på vev.
Ein artikkel om forskinga vår på samspelet mellom vertsceller og tuberkelbakterien vart nett publisert i tidsskriftet Nature Communications, Plasma membrane damage causes NLRP3 activation and pyroptosis during Mycobacterium tuberculosis infection.
I artikkelen presenterer me at tuberkelbakterien kan skade den ytre plasmamembranen til vertscella. Brot på cellas ytre barriere gjev ionefluksar, som fører til at eit inflammasom vert aktivert i cella. Då vil cella døy medan den slepp ut signalmolekyl som skapar inflammasjon. Samstundes vil bakteriane sleppe fri i eit kaotisk miljø der dei har god tilgang på næring og er klare til å infisere nye celler som kjem for å reparere skadane. Mekanismen me har funne liknar det me ser ved sterile skader på cellene, til dømes frå silikakrystaller. Det tyder på at den kan vere relevant for andre sjukdommar enn tuberkulose, til dømes silikose.

Denne tredimensjonale figuren viser ei immuncelle (i grått) som fagosyterer tuberkelbakteriar (i lilla). Illustrasjon: Marianne Beckwith/Sindre Ullmann
Samarbeid gjer betre forskning
Avansert immunologisk forsking er avhengig av gode samarbeid. Samarbeidet vårt med Harald Stenmark ved Senter for kreftcelle-reprogrammering i Oslo, eit senter for fremragande forsking, har vore særs verdifullt for dette prosjektet. Stenmark er leiande innanfor forsking på ESCRT-maskineriet, eit system som mellom anna er involvert i reparasjon av plasmamembranen i celler. Dette samarbeidet har gjort oss betre i stand til å studere kva for rolle ESCRT-maskineriet kan ha i å reparere skadar tuberkelbakterien påfører plasmamembranen.
I arbeidet vårt med å studere desse mekanismane har me gjort nytte av eit breitt spekter av mikroskopimetodar som er tilgjengelege ved NTNU. Ved å bruke lysmikroskopi kan me sjå levande celler medan dei vert infisert av tuberkelbakteriar. Slik kan me følgje dei dynamiske prosessane og avdekke hendingsgangen når bakterien infiserer ei immuncelle. Dette gjer det mogleg for oss å sjå både kva som er konsekvensane av gitte hendingar, som til dømes aktivering av inflammasomet, men også kva som hende med cella før inflammasomet vart aktivert. Denne typen avbilding er nyttig når ein studerer heterogene cellekulturar, der augneblinksbilete og gjennomsnitt ikkje kan svare på alle spørsmål. Cellular & Molecular Imaging-kjernefasiliteten (CMIC) ved NTNU drifter mange instrumenter og i arbeidet vårt har me nytta heile fire ulike lysmikroskop drifta av CMIC.
Videre i artikkelen gjer me nytte av ein avansert teknikk kalla korrelativ lys-elektronmikroskopi for å studere den tredimensjonale ultrastrukturen til celler infisert med tuberkelbakteriar. Kjernen i denne teknikken er å avbilde den same cella med både lys- og elektronmikroskopi for slik å danne eit multidimensjonalt sett med data. Ved å anvende denne teknikken vart me dei fyrste til å vise korleis strukturen og omgivnadane til eit inflammasom ser ut inni ei celle. For å oppnå dette har me samarbeida med og brukt utstyr ved både NTNU Nanolab og CMIC.
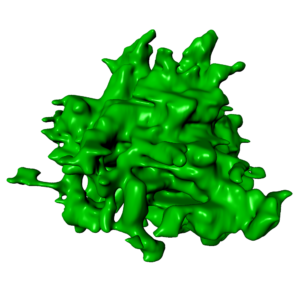
Dette er ei 3D-rekonstruksjon som viser strukturen til eit inflammasom – for fyrste gong i ei primærcelle. Illustrasjon: Marianne Beckwith/Sindre Ullmann
Våre studiar på tuberkelbakterien held fram i trygge omgivnader
Tuberkelbakterien er klassifisert som ein biosikkerheitsnivå 3-organisme, og arbeid med den er difor nøydd til å gå føre seg på eit avgrensa laboratorium der strenge og omfattande prosedyrar må følgjast. Me er heldige som har eit eige lysmikroskop der inne, slik at me i trygge omgivnader kan studera tuberkelbakterien når den infiserer levande immunceller.
Trude Helen Flo er professor i cellebiologi, og leiar forskingsgruppa me er ein del av ved CEMIR. Trude sin bakgrunn er derimot frå sivilingeniørstudiet i bioteknologi ved NTNU. Hennar tverrfaglegheit kan ein sjå tydelege spor av i personane ho har rekruttert til prosjektet dei siste åra, ein strategi som har vore direkte bidragsytande til artikkelen me nå har publisert. Marianne og Kai Sandvold Beckwith, fyrsteforfattarane av studien, er også sivilingeniørar. Dei har nå fortsette karrierane sine i post doc-stillingar ved European Molecular Biology Laboratory i Heidelberg, eit av flaggskipa for livsvitskap i Europa. Stipendiatane Sindre Ullmann og Ragnhild Sætra tek over stafettpinnen frå dei og har i likskap med Marianne og Kai bakgrunn frå det interdisiplinære sivilingeniørstudiet i nanoteknologi. Framover vil dei forske meir på interaksjonane mellom tuberkelbakterien og immunceller.

Ragnhld Sætra og Sindre Ullmann
