Blogger: Trude Helen Flo, nestleder CEMIR
I CEMIR skal vi jobbe med betennelse, eller inflammasjon. Hvorfor? Fordi inflammasjon er viktig for helse, også global helse, og vi tror at en bedre forståelse av hvordan inflammasjonsprosessene initieres og reguleres vil bidra til utvikling av nye medikamenter og vaksiner.
Inflammasjon er kroppens reaksjon på fare. Celler fra immunforsvaret vårt har reseptorer som kjenner igjen strukturer fra mikrober, vevsskade eller skadelige endringer av kroppens egne molekyler. Binding til reseptorene aktiverer immuncellene og en akutt inflammasjon oppstår. Cellene skiller ut signalmolekyler for rekruttering av nye immunceller og antimikrobielle program aktiveres, alt med det formål å fjerne angriperen, reparere skaden og lege sår. Prinsippene er de samme, men reseptorene som aktiveres er spesifikke for ulike molekyler og dermed kan immunforsvaret tilpasse responsen til hvilken type angrep kroppen er utsatt for.
Klarer ikke kroppen å rydde opp kan inflammasjonen bli kronisk, som sett ved leddgikt, inflammatorisk tarmsykdom, noen typer kreft og i hjerte-kar sykdom. Og her ligger nøkkelen: Om vi kjenner de molekylære detaljene i hvilke mekanismer immuncellene mobiliserer ved ulike angrep så kan vi identifisere nye og spesifikke terapeutiske mål for en rekke sykdommer der inflammasjon er sentralt.
Om vi kjenner de molekylære detaljene i hvilke mekanismer immuncellene mobiliserer ved ulike angrep så kan vi identifisere nye og spesifikke terapeutiske mål for en rekke sykdommer der inflammasjon er sentralt.
Hva så med inflammasjon i et globalt helseperspektiv? Nyere tall viser at selv om infeksjonssykdommer fremdeles er en betydelig dødsårsak i lavinntektsland så er det et skifte mot at befolkningen blir eldre og dør av kardiovaskulær sykdom, lungesykdom, diabetes, demens og kreft – kroniske sykdommer med et betydelig inflammasjonsbidrag (Lozano et al, The Lancet, 2012 380:9859: 2095 – en studie der 488 forskere fra 50 land bidro i å kartlegge ”global burden of disease” anno 2010). Noen av de mest dødelige infeksjonssykdommene er også kroniske, som HIV/AIDS, tuberkulose og malaria.
Min forskningsgruppe er spesielt interessert i tuberkulose som forårsakes av bakterien Mycobacterium tuberculosis. Det dør fremdeles 1,5 millioner mennesker av tuberkulose hvert år, og en estimerer at en tredjedel av verdens befolkning er infisert med tuberkelbasillen. Behandlingen er komplisert og langvarig, det er økende forekomst av resistens mot de medikamentene vi har i dag, og den eneste tilgjengelige vaksinen, BCG-vaksinen, er ikke effektiv mot voksen lungetuberkulose. Det er derfor et stort behov både for ny vaksine og mer effektive medikamenter mot tuberkulose.
Det dør fremdeles 1,5 millioner mennesker av tuberkulose hvert år, og en estimerer at en tredjedel av verdens befolkning er infisert med tuberkelbasillen.
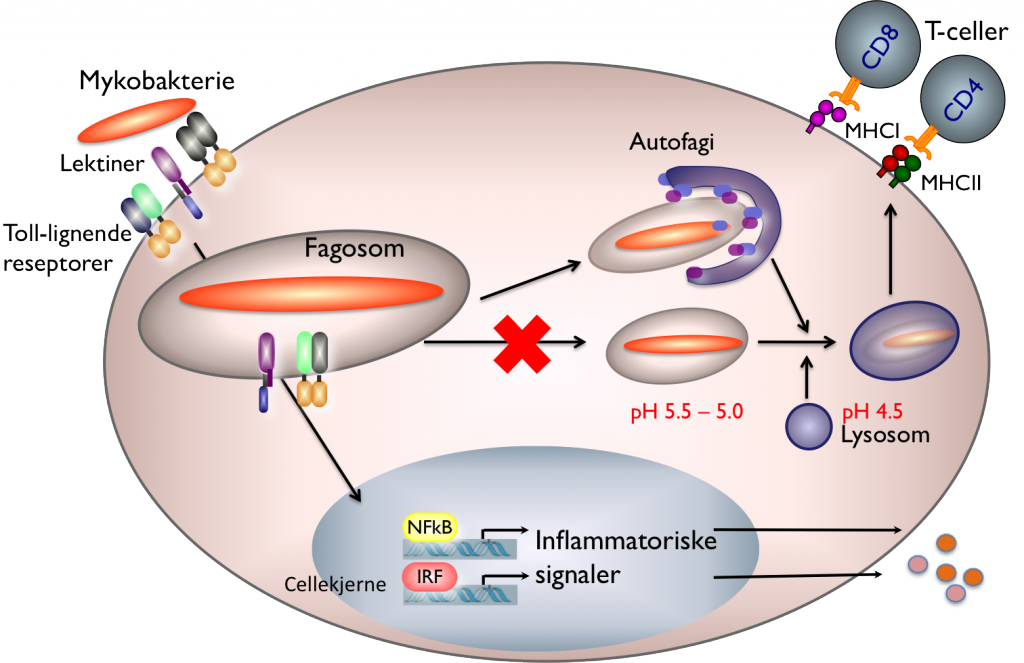
Vi tror vi kan bidra til dette ved å studere samspillet mellom mykobakterien og vertens immunforsvar, og vi fokuserer spesielt på hvordan mykobakterien klarer å overleve inne i sin verste fiende, makrofagen. En rekke prosesser settes i gang i makrofagen i det mykobakterien binder til reseptorer på overflaten (se figur 1): lektin reseptorer bidrar til at bakterien tas opp i cella ved at cellemembranen invagineres og danner en lukket vesikkel som omslutter bakterien. Denne prosessen kalles fagocytose og vesikkelen et fagosom. Samtidig aktiveres inflammasjonsveiene i makrofagen gjennom Toll-lignende reseptorer, signalmolekyler skilles ut og antibakterielle program initieres. Så skjer det som gjør mykobakterien spesiell: Normalt ville fagosomet bli gradvis forsuret, bakterien ødelagt og biter av den presentert for mer profesjonelle immunceller, T-cellene. Patogene mykobakterier klarer å hindre denne prosessen og leve et langt liv i verten uten å bli drept. Dette kalles immune evasion og kan forklare hvorfor så mange mennesker går rundt med latent tuberkulose.
Vi har som mål å forstå de molekylære mekanismene som gjør dette mulig, både hos mykobakterien og i makrofagen. Dersom vi kan styrke makrofagen eller svekke mykobakterien slik at T-cellene blir aktivert på en hensiktsmessig måte så kan vi forhåpentligvis få en bedre immunrespons som gir effektivt drap og immunitet. Det er bare gjennom en detaljert forståelse av hva som skjer mellom mykobakterien og verten at vi kan finne nye terapeutiske mål og utvikle nye vaksiner.
Mykobakterier trenger jern for å vokse. Vi har vist at kroppen har et antibakterielt protein, lipokalin 2, som nettopp sulter bakterier for jern (Flo et al, Nature 2004). Dessverre har vi også funnet at lipokalin 2 ikke er så effektivt i forsvar mot mykobakterier fordi de gjemmer seg inni makrofagene i fagosomer der lipokalin 2 ikke har adgang (Halaas et al, Journal of infectious diseases 2010, se figur 2).
Dersom vi finner andre måter å sulte mykobakteriene for jern på kan de svekkes tilstrekkelig til at makrofagene klarer å ta hånd om dem. Bedre kjennskap til mykobakterienes jernmetabolisme kan avdekke nye angrepspunkt.
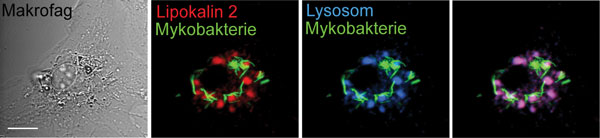
Figur 2: Mykobakterier tar bolig i kroppens makrofager og gjemmer seg for forsvarsproteiner som lipokalin 2. Bildene viser en makrofag som er infisert med fluorescerende mykobakterier (grønt) og deretter merket med forsvarsproteinet lipocalin 2 (rødt) og lysosomer (blått). Vi ser at lipokalin 2 blir transportert i lysosomer hvor det blir nedbrutt (overlapp rødt og blått blir lilla), mens mykobakteriene trafikkerer til andre deler av makrofagen hvor den verken blir nedbrutt eller møter lipokalin 2. Dette kalles ”immune evasion”, og mykobakterier er eksperter på dette. Kilde: Halaas et al, Journal of Infectious Diseases 2010. Bilder: Øyvind Halaas
Nyere forskning har vist at makrofagene kan ta hånd om mykobakteriene ved å bruke et indre renovasjonssystem, autofagi. Autofagi ligner på fagocytose, men skjer inni cellene ved at ødelagte organeller, aggregerte proteiner, bakterier og virus omsluttes av en indre membran (Figur 1). Vesikkelen som dannes kalles et autofagosom, og innholdet brytes ned ved fusjon med lysosomer på samme måte som ved normal fagocytose.
Autofagi reguleres av inflammasjonsproteiner og inflammasjon er påvirket av autofagi. Vi tror at en bedre forståelse av sammenhengene kan gjøre det mulig å påvirke disse prosessene i en retning som gir økt drap av mykobakteriene, bedre aktivering av T-cellene, og forhåpentligvis løse infeksjonen. Autofagi er også viktig i hjertesvikt, kreft og nervesykdommer: defekter i autofagi kan gi økt aggregering av proteiner som sett ved Alzheimers.
CEMIR håper å avdekke likheter og forskjeller i molekylære inflammasjonsmekanismer som på sikt kan gi oss nye medikamenter, nye vaksiner, og nye diagnostiske verktøy.
Så er inflammasjon relevant for global helse? Definitivt. Inflammasjonsmekanismene er felles for infeksjoner og kroniske inflammatoriske sykdommer som er forårsaket av skadelige endringer i kroppens egne molekyler. Men de brukes forskjellig, og gjennom CEMIR håper vi å avdekke likheter og forskjeller i molekylære inflammasjonsmekanismer som på sikt kan gi oss nye medikamenter, nye vaksiner, og nye diagnostiske verktøy.
Den offisielle åpningen av NTNUs fire nye sentre for fremragende forskning SFF var mandag 10. Juni.  CEMIR er ett av disse sentrene. I vårt senter skal vi forske på nye mekanismer som setter i gang inflammasjonsresponser. Vi håper med dette å få kunnskap som kan peke på nye metoder for behandling og diagnostikk av sykdommer der inflammasjon spiller en avgjørende rolle. Du kan lese mer om CEMIR på http://www.ntnu.edu/cemir
CEMIR er ett av disse sentrene. I vårt senter skal vi forske på nye mekanismer som setter i gang inflammasjonsresponser. Vi håper med dette å få kunnskap som kan peke på nye metoder for behandling og diagnostikk av sykdommer der inflammasjon spiller en avgjørende rolle. Du kan lese mer om CEMIR på http://www.ntnu.edu/cemir
I løpet av juni vil du få lese flere blogginnlegg fra CEMIR sitt forskningsmiljø.