Blogger: Bendik Lund
Når barn med akutt lymfatisk leukemi (blodkreft) behandles med cellegift ser vi en stor variasjon av bivirkninger. Blant annet får noen barn langt mer alvorlige infeksjoner enn andre. Kanskje kan denne forskjellen forklares med naturlige gen-variasjoner?
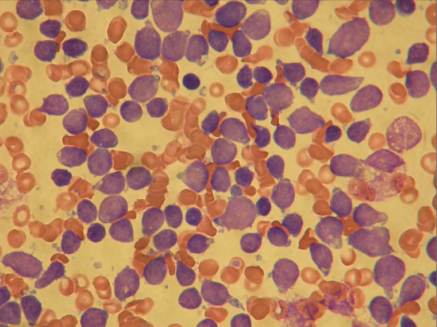
Foto av beinmargsutstryk som viser leukemi ved diagnosetidspunktet. Mesteparten av de lilla cellene er leukemiceller. Det sees ellers normale røde blodceller. (Foto: Bendik Lund).
I dag har vi omfattende ny kunnskap om den naturlige variasjonen i arvestoffet. Denne variasjonen forklarer noe av forskjellene mellom mennesker, for eksempel høyde, hårfarge, risiko for sykdom og kroppens reaksjoner på medikamenter (farmakogenetikk). Det finnes mange typer DNA-variasjoner og en av de vanligst forekommende er enkeltnukleotidpolymorfier, såkalte SNPs (eng.: single nucleotide polymorphisms). DNA består av lange kjeder med basepar (totalt 3 milliarder) og en SNP forekommer ca. for hvert 300’de basepar.
Vi ville undersøke hvilken rolle den naturlige genetiske variasjonen har for utvikling av bivirkninger hos barn som behandles for blodkreft. Den vanligste formen for blodkreft hos barn er akutt lymfatisk leukemi og i Norge får ca. 30-40 barn denne diagnosen hvert år. Behandlingen består av ulike cellegifter gitt over en periode på 2,5 år. Totaloverlevelsen ligger i dag på ca. 85 %. Behandlingen medfører mange bivirkninger, bl.a. nedsatt immunforsvar og infeksjoner. I verste fall kan behandlingen føre til så alvorlige bivirkninger at pasienten dør.
Kunnskap om farmakogenetisk variasjon (ulik virkning av legemidler som skyldes genene) benyttes allerede i standardbehandlingen ved akutt lymfatisk leukemi. Cellegiften 6-merkaptopurin doseres på bakgrunn av hva slags genvariant pasienten har for enzymet som omdanner 6-merkaptopurin (TPMT-genvarianter).
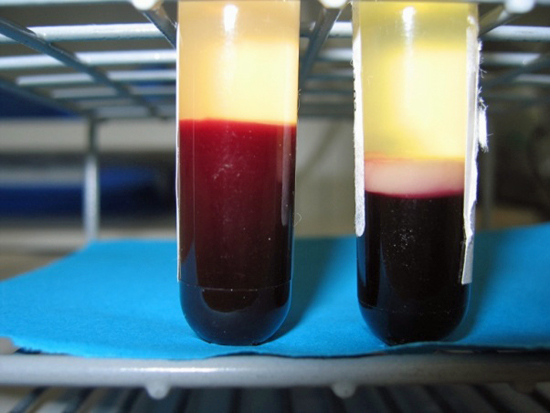
Glasset til venstre inneholder en blodprøve fra en frisk person, og glasset til høyre er en blodprøve fra et barn med leukemi. ‘Leukemi’ betyr ‘hvitt blod’ som man tydelig kan se på det hvite sjiktet med celler i prøven til høyre (Foto: Bendik Lund).
I samarbeid med en forskergruppe ved Rigshospitalet i København ble det identifisert 2300 kandidatgener som kan ha betydning for barn med akutt lymfatisk leukemi. Samtlige av disse ble analysert hos 69 danske leukemibarn, og genmønstre ble sammenliknet med kliniske data for infeksjoner de første 50 dagene av leukemibehandlingen. Vi identifiserte en genprofil som med stor nøyaktighet kunne forutsi risiko for infeksjoner i denne tidlige fasen av behandlingen som ofte er den mest kritiske.
Hvis disse eller liknende funn blir bekreftet vil en enkelt blodprøve av pasienten ved start av behandlingen kunne gi raskt svar på om pasienten har forhøyet risiko for infeksjoner. Hvis pasienten har økt risiko kan behandlingen i større grad «skreddersys» ved for eksempel å gi forebyggende antibiotikabehandling eller ved å redusere behandlingsintensiteten. En slik strategi vil i så fall kunne føre til færre bivirkninger og økt overlevelse.
Les mer:
- Host genome variations and risk of infections during induction treatment for childhood acute lymphoblastic leukaemia
- Risk factors for treatment related mortality in childhood acute lymphoblastic leukaemia

