Av Markus Haug, forsker ved CEMIR, Institutt for klinisk og molekylær medisin, NTNU
Dette blogginnlegget handler om historien bak en artikkel som vi nylig har publisert i tidsskriftet Nature Communications. Artikkelen er den første publikasjonen fra vår arbeidsgruppe “Molecular Mechanisms of Mycobacterial and HIV Infections” ved CEMIR på HIV. Vi er veldig stolte over våre funn og artikkelen, siden det slett ikke er en selvfølge at man som nybegynner i feltet lykkes med å publisere sine resultater i et høyt rangert tidsskrift.

Markus Haug og forskerkollega Hany Z. Meås labben i Kunnskapssenteret ved NTNU. Foto: Jacob Storgaard Jensen
I artikkelen beskriver vi en ny og tidligere ukjent mekanisme for hvordan vi kan vekke HIV fra sin dvaletilstand i behandlede pasienter og hvordan dette lurer HIV til å avsløre seg selv.
Hvorfor det kan være en god ide å vekke HIV i pasienter, kan du også lese i Gemini: Vil lure HIV-virus ut av hjemmestedene.
Hvorfor trenger vi å forske på HIV?
Når en person blir smittet med HIV, går viruset til angrep på immuncellene som kroppen normalt skulle bruke for å bekjempe det. Disse immuncellene kalles for CD4 T-celler. Hvis ikke HIV infeksjonen blir behandlet, dør CD4 T-cellene etter hvert og kan ikke bidra til å forsvare kroppen mot sykdommer og infeksjoner. Dette fører til en tilstand der pasientens immunsystem svikter som kalles for AIDS («Acquired Immune Deficiency Syndrome»).
Heldigvis kan en HIV-infeksjon i dag behandles med medikamenter. Behandlingen er ofte så effektiv at viruset ikke er målbart i blodet lengre og pasienten kan ikke overføre sykdommen til andre mennesker. HIV har gått fra å være en dødelig sykdom til å bli en kronisk sykdom.
Men det er nettopp dette: En kronisk sykdom. Vi kan behandle, men ikke kurere HIV-infeksjonen og medisinene må tas livet ut.
HIV setter nemlig en kopi av sitt eget arvestoffet (DNAet) inn i noen av våre immunceller og gjemmer seg der. HIV arvestoffet inneholder oppskriften for å lage nye virus, men HIV medikamentene hindrer at dette skjer. Den dagen pasienten slutter å ta medisinene, vil HIV våkne opp fra dvalen i disse såkalte reservoarceller og begynne å lage nye virus igjen.
For å kunne kurere HIV må vi finne ut hvordan vi kan fjerne HIV arvestoffet fra reservoarcellene. Basalforskning må derfor bidra med ny kunnskap rundt mekanismene for hvordan vi kan vekke viruset fra dvaletilstanden og gjøre det synlig for immunforsvaret og medikamenten.
Hvorfor tror vi at vi kan bidra til HIV forskning?
Ved CEMIR har vi mye kompetanse på hvordan immunsystemet oppdager bakterier og virus og på inflammasjon. Inflammasjon, eller betennelse, er en forsvarsreaksjon fra kroppen sin side mot skade og er absolutt nødvendig for å bekjempe en infeksjon. Men en langvarig kronisk inflammasjon er skadelig for kroppen. Våre immunceller har spesielle reseptorer som kan oppdage forskjellige «faresignaler» og ved hjelp av disse immunreseptorene settes inflammasjonen i gang.
I vårt forskningsprosjekt på HIV ønsket vi å finne ut mer om hvordan HIV blir oppdaget av disse immunreseptorer når viruset infiserer sine vertsceller (CD4 T-cellene) og hvordan dette fører til inflammasjon. Dette er spesielt spennende siden det ble beskrevet at HIV pasienter har en svak men vedvarende kronisk inflammasjon, selv om dem får medisiner.
Fra ide til forskningsprosjekt
Før vi kunne komme i gang med forskning på HIV måtte mye på plass:
- For å få prøver fra HIV pasienter krevdes det godkjenning fra etikk-komiteen (REK).
- Vi måtte etablere samarbeid med infeksjonsavdeling og mikrobiologen ved St Olavs hospital samt HIV pasienter fra Trøndelag.
- Arbeid med HIV krever et godt sikret laboratorium med strenge rutiner for hvordan det jobbes med viruset. Forsøkene med HIV ble gjennomført på et spesielt laboratorium, et såkalt «inneslutningsnivå 3» (BSL-3) laboratorium på Laboratorie-senteret ved St. Olavs hospital. BSL-3 er det nest-høyeste sikkerhetsnivået for arbeid med virus og bakterier i verden (og det høyeste i Norge). Så det krevdes en hel haug med dokumentasjon på rutiner og sikkerhetstiltak samt omfattende trening for oss forskere før vi kunne sette i gang.
- For prosjektet valgte vi å jobbe med primærceller, det vil si celler som isoleres fra blod av friske donorer eller HIV pasienter. Forskning på primærceller er, på grunn av stor genetisk variasjon mellom mennesker, mer utfordrende enn forskning på cellelinjer eller i en dyremodell. Samtidig er det kun med primærceller mulig å finne ut hva som virkelig foregår i menneskekroppen. Her samarbeider vi med blodbanken på St. Olavs hospital.
Å få det administrative på plass, etablere metodene og komme i gang med HIV forskningen har vært en lang og av og til litt kronglete prosess som startet helt tilbake i 2011. Der fikk jeg for første gang forskningsmidler fra Samarbeidsorganet for å komme i gang med forskning på HIV og mykobakterie-infeksjon. Men først da vi i 2014 fikk nye midler til HIV forskning samt en stipendiatstilling (Hany Z. Meås), ble det mulig å begynne for alvor med forskning på HIV.
Arvestoffet fra HIV kan føre til inflammasjon i vertscellene
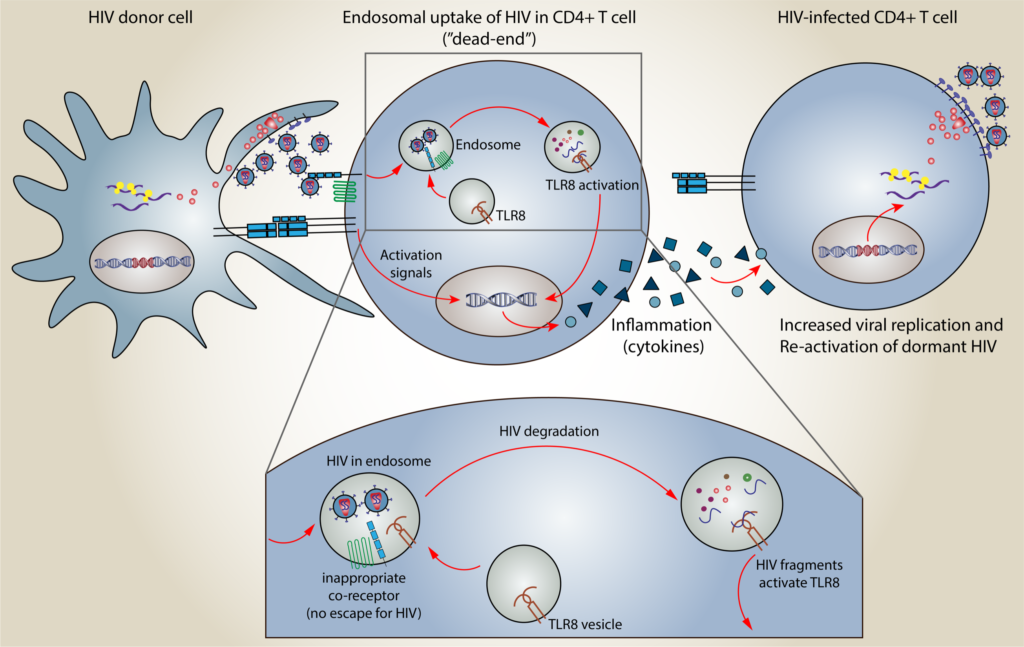
Vi begynte med å undersøke funksjonen til noen spesielle immunreseptorer, såkalte toll-like reseptorer (TLR), i CD4+ T-celler (HIV vertscellene). Hovedoppgaven til disse reseptorene er å oppdage «faresignaler» når en celle blir infisert og å sette i gang inflammasjon for å varsle kroppen om infeksjonen. Det vi fant var, at stimulering av en immunreseptor kalt TLR8 førte til en sterk inflammasjonsrespons i CD4 T-cellene (HIV vertscellene). Denne responsen var tidligere ukjent i CD4 T-celler. I tillegg visste vi at et av «faresignalene» som oppdages av TLR8 kan nettopp være arvestoffet fra HIV. Dette var spennende!
Nå måtte vi finne svar på en rekke spørsmål – og det var her det egentlige arbeidet begynte: Vi måtte finne ut om TLR8 og arvestoffet fra HIV i det hele tatt kommer i kontakt i CD4 T-celler som infiseres. Vi måtte å oppklare mekanismen og effekten av TLR8 aktivering i CD4 T-celler så nøyaktig som mulig. Og vi måtte også prøve å finne ut hvilken rolle TLR8 aktivering i CD4 T-celler bar under en HIV-infeksjon og i HIV-infiserte pasienter.
For å finne svar på alle disse spørsmålene, har vi delt opp jobben: Hos oss på labben i Kunnskapssenteret jobbet jeg med å finne ut mest mulig om effekten og mekanismen bak effekten, mens forskerkollega Hany Z. Meås studerte om effekten i tillegg til økt inflammasjon også påvirker en HIV-infeksjon.
Vi har etablert lokalt, nasjonalt og internasjonalt samarbeid i løpet av prosjektet: I samarbeid med en arbeidsgruppe i Oslo fant vi ut mer om mekanismen. Gjennom samarbeid med Kina/USA har vi fått et molekyl som kan hemme TLR8 og dermed vise at effekten vi fant er spesifikt for TLR8. Gjennom lokalt samarbeid med infeksjonsavdelingen ved St. Olavs Hospital har vi fått celler fra HIV pasienter og målt viruskopier i prøvene i samarbeid med mikrobiologen på sykehuset.
Etter hvert som historien vokste, ble flere fra arbeidsgruppa dratt inn i prosjektet for å få de siste brikkene på plass. Siden alle i vår arbeidsgruppe har sin «spesialkompetanse», sparer det mye tid hvis vi kan spørre hverandre om hjelp i stedet for å bruke mye tid på å lære oss metoden selv.
En immunreseptor som kan vekke HIV som ligger i dvale
Til slutt satt vi med en historie om en ny rolle for immunreseptoren TLR8 i CD4 T-celler og betydningen av dette for HIV-infeksjon:
Når CD4 T-celler infiseres med HIV, kan i noen tilfeller viruspartiklene havne i små sekker (endosomer) i CD4 T-celler og bli fanget der. Virus som er fanget i disse sekker brytes ned og HIV arvestoffet blir synlig for immunreseptorer som er i sekken. HIV arvestoffet kan så oppdages av TLR8 og dette fører til inflammasjon som sender signaler til andre immunceller om hjelp. Denne mekanismen kan muligens bidra til å forklare den vedvarende kroniske inflammasjonen som man ser i HIV pasienter selv om dem får behandling. Med tanke på utvikling av en fremtidig kur for HIV, er spesielt våre resultat fra forsøk med celler fra HIV pasienter spennende: Vi fant ut at inflammasjonen forårsaket av TLR8 aktiveringen kan vekke HIV som lå i dvale i pasientenes reservoarceller.
Om viruset kan vekkes fra gjemmestedet sitt i reservoarcellene, kan det bli tatt hånd om av kroppens eget immunforsvar eller av medisiner. Da ville pasienten bli kvitt viruset og være kurert.
Mange forskere har derfor prøvd å finne metoder for å vekke HIV fra dvaletilstanden i reservoarcellene, men alle kliniske studier feilet enn så lenge. Våre funn indikerer at TLR8 stimulering kan være en veldig effektiv strategi for å vekke HIV i reservoarcellene. Dette vil vi følge opp i nye studier som vi håper bringer oss enda nærmere en mulig framtidig behandling av HIV. Slike studier kalles translasjonelle da de bringer funn fra basalforskningen nærmere klinikken, som er det vi til syvende og sist jobber for.
Selvsagt gikk ikke alt alltid etter planen
En del sidespor ble fulgt opp litt for lenge, forsøk har mislyktes eller ført til flere spørsmål enn svar. Da jeg begynte min PhD, fortalte veilederen min at jeg må regne med at opptil 90% av forsøkene mislykkes. Det var i hvert fall ikke langt fra sannheten. Å jobbe som forsker kan være frustrerende. Det er ingen som teller hvor mange ekstratimer man jobber og det finnes veldig få forskere som er ansatt i fast stilling. I tillegg til å stå på lab og gjøre forsøk (som er det artigste og viktigste ved å jobbe som forsker) er det alltid en rekke andre oppgaver som haster og spiser altfor mye av den dyrebare forskningstiden. Det skal undervises, veiledes, leses litteratur, presenteres resultat, skrives søknader, rapporter og artikler. Dessuten holder man som forsker vanligvis på med mer enn ett prosjekt om gangen, så det er viktig å holde fokus og prioritere oppgavene så godt som mulig.
Så hvorfor jobbe som forsker?
Fordi det er artig å ha en idé eller hypotese, tenke ut noen forsøk til å teste den og jobbe sammen i lag for å finne ut ting som ingen har beskrevet før – og som en gang i framtida kan bidra til bedre pasientbehandling. Den som blir forsker med drømmen om å redde verden eller kurere sykdommer kommer sannsynligvis til å bli skuffet når hun/han møter realiteten i forskerhverdagen. Det kreves en genuin entusiasme og glede i å finne ut av sammenheng og mekanismer i biologien og medisinen. I tillegg må man også være forberedt på at de fleste basalforskningsprosjekt bidrar med små brikker til å tette små kunnskapshull – men hver brikke er viktig og må være solid for at «kunnskapstårnet» blir stødig til slutt. For å kunne kurere sykdom må vi forstå hva som skjer galt og hvordan dette skjer. Først da vil vi kunne utvikle nye terapier til behandling av sykdommer. Her satt vi til slutt igjen med en fin historie om en tidligere ubeskrevet mekanisme. Og det er gøy!
Langsiktig forskningsstøtte er viktig for forskning på høyt internasjonalt nivå
HIV infeksjon i CD4 T-celler er forskning som var ny for oss ved CEMIR. Med publisering av denne artikkelen har vi klart å sette CEMIR på kartet i dette forskningsfeltet. Det tok oss mer eller mindre åtte år fra beslutningen om å sette i gang med forskning på HIV til publisering av den første store artikkelen. Dette var hovedprosjektet for en forsker og en stipendiat i flere år. Vi jobbet tett sammen og delte på førsteforfatterskapet. Det var viktig at også gruppelederen støttet oss og hadde ambisjoner om HIV forskningen. I tillegg er det mange andre i og utenfor forskningsgruppen og på sykehuset som har bidratt. Det gikk mer enn ett år fra første innsending til publisering av artikkelen. I den tida ble det to runder med revisjon og gjennomføring av utallige ekstraforsøk med celler fra mange flere HIV pasienter og friske blodgivere.
Det er fantastisk når man ikke gir opp og når laginnsats til slutt fører til ny kunnskap som kanskje en dag kan bidra til ny behandling. I tillegg sitter vi igjen med en rekke side- og oppfølgingsprosjekt samt et bredt spektrum av metoder som er veldig nyttige i videre forskning på HIV, men også for mange andre prosjekter ved CEMIR/IKOM og St. Olavs hospital.
Ikke alle forskningshistorier har en happy ending, ofte tar pengene slutt før prosjektet er publisert og da blir det vanskelig å få inn nye midler. Oppstart av arbeid på nye forskningsfelt og etablering av nye metoder tar tid. Slike prosjekt er derfor dårlig egnet til et doktorgradsprosjekt som skal ferdigstilles i en periode på tre år. Skal man satse på nye og større prosjekt med ambisjoner om å drive med internasjonalt fremragende forskning (forskning som blir sett, sitert og gjør en forskjell) vil det ta tid og koste penger. Det krever også samarbeid i og utenfor gruppen og langsiktig støtte fra gruppelederen og institusjonen der en jobber. Vi var veldig heldige her.
Derfor er dette blogginnlegget også ment som en appell for en mer langsiktig satsing i forskningen og for å støtte opp om basalforskningen innen medisin. 10-års finansieringsperspektivet hos CEMIR gjennom Norges Forskningsråd sin SFF-ordning (Senter for Fremragende Forskning) er veldig viktig for slike prosjekt. I tillegg synes jeg det er viktig at postdoktorer og forskere kan ha en trygg jobb i mer enn noen år om gangen for å kunne satse på større og mer ambisiøse prosjekt i nye forskningsfelt. Flere faste forskerstillinger kunne være et tiltak for å få flere forskere til å satse på slike prosjekt. Forhåpentligvis var dette ikke slutten, men starten på HIV forskning ved CEMIR/IKOM og St. Olavs hospital.
Finansieringskilder:
«Samarbeidsorganet» («Regionalt samarbeidsorgan for utdanning, forskning og innovasjon HMN»): 2011-2014, 2014-2017, 2017-2022
Norges Forskningsråd (NFR): 2014-2017, CEMIR (NFR Senter for Fremragende Forskning)