Gjesteblogger: Marianne Frøyland, Kreftforeningen
Nye målemetoder angir om en ny medisin er aktuell for en pasient eller ei. Og om pasienten har effekt av behandlingen. Dette vil sikre pasienten kortest vei til riktig behandling.
Brystkreft er ikke en sykdom som kan behandles likt i alle pasienter, fordi den er delt inn i flere undergrupper som trenger ulik behandling. Disse undergruppene defineres ut i fra hvilke antenner (reseptorer) som sitter utenpå kreftcellene og om andre spesifikke gener er over- eller underuttrykt i kreftcellene.
Den mest aggressive formen for brystkreft defineres som trippel-negativ for de aktuelle reseptorene og kalles basal-lignende brystkreft. Den står for 15-20 prosent av all brystkreft.
Hormon- og antistoffbehandling som gis ved reseptor positive former for brystkreft i tillegg til kirurgi, cellegift og stråling har altså vanligvis liten effekt for basal-lignende brystkreft. Det foregår derfor iherdig forskning for å finne ny medisin som kan øke overlevelsen også for denne gruppen av brystkreftpasienter.
– Når en ny medisin er på banen er det viktig å vite om medisinen faktisk vil virke for den enkelte pasient. Vi har derfor utviklet metoder for å kunne måle dette, sier professor og prosjektleder Geir Bjørkøy ved Høgskolen i Sør-Trøndelag.
Signalfeil i cellene
Inne i alle cellene våre er det et stort nettverk av signalveier som krysser hverandre mange ulike steder og har stor påvirkning på hverandre. Gjennom disse signalveiene kontrollerer cellene blant annet celledelingen. Feil i disse signalveiene kan derfor føre til ukontrollert cellevekst og dermed kreft.
– Du kan sammenligne det med T-banenettet for en storby hvor de ulike linjene bindes sammen av mange felles knutepunkter. Dersom det er signalfeil på en linje vil dette påvirke trafikken til mange av de andre linjene også, forklarer Bjørkøy.
For pasienter med basal-lignende brystkreft er det tidligere vist at de ofte har feil i en signalvei som kalles PI3K slik at denne er overaktiv i cellene. Dette påvirker mange funksjoner i cellene.
Flere målrettede medisiner som hemmer akkurat PI3K signalveien er under utprøving i kliniske studier for pasienter med basal-lignende brystkreft. To av disse medisinene er brukt i utviklingen av de nye målemetodene.
Hvilke pasienter vil kunne ha nytte av medisinen?
For å kvalitetssikre metodikken har Bjørkøy først jobbet med en musemodell av basal-lignende brystkreft. Her er kreftvev fra en brystkreftpasient transplantert til brystet til en mus hvor det deretter dannes en svulst.
– Vi tar en vevsprøve av svulsten og lager tynne snitt av denne som vi farger med et fluorescerende antistoff mot en aktiv komponent i PI3K signalveien og tar bilder ved hjelp av en spesiell laserscanner. Da kan vi bestemme om svulsten har en overaktiv PI3K signalvei eller ei, forklarer Bjørkøy.
– Det viktigste med denne metoden, som kalles nær-infrarød immunfluorescens billedanalyse, er at vi på en mye bedre måte kan bestemme hvor mye PI3K signalveien er aktivert, sier Bjørkøy entusiastisk.
Det at forskjeller i aktiviteten kan måles kvantitativt og ikke kun bestemmes av det blotte øyet er et svært viktig poeng. Metoden vil da lettere kunne brukes av ulikt personale ved et rutinelaboratorium på et sykehus.
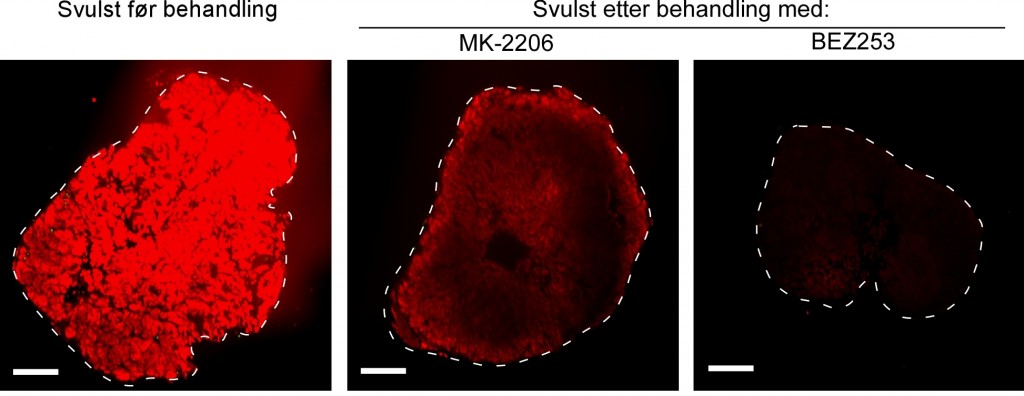
Rødfargen viser aktiviteten til PI3K signalveien i svulsten hos mus. Bildene viser at PI3K signalveien er overaktiv i ubehandlet basal-lignende brystkreft. Behandling med medisinene MK-2206 og BEZ253 viser at PI3K aktiviteten går ned og at BEZ253 gir bedre effekt enn MK-2206. Foto: Geir Bjørkøy.
PI3K aktiviteten ble deretter testet i vevsprøver (biopsier) fra pasienter med basal-lignende brystkreft. To av fem pasienter viste seg å ha overaktiv PI3K signalvei. Sekvensering har tidligere vist at nesten alle basal-lignende brystkreftceller har feil (mutasjoner) i PI3K signalveien. De nye funnene fra Bjørkøy og medarbeidere foreslår derfor at ikke alle genetiske endringer i signalveien faktisk fører til at PI3K signalveien blir overaktiv.
– Dette viser hvor viktig det er med funksjonelle studier i tillegg til sekvensering for å avgjøre om en pasient oppfyller vilkårene for at medisinen skal kunne ha effekt, påpeker Bjørkøy.
Gir medisinen den ønskede effekten?
I musemodellen brukte Bjørkøy også sin kvantitative billedanalyse for å avgjøre om PI3K aktiviteten avtok etter behandling med en av de to nye målrettede PI3K hemmerne. Denne metodikken krever derimot at det tas en ny biopsi etter at behandlingen er startet. For å kunne teste det samme i pasienter trengs en metodikk som ikke krever fysisk inngrep.
– Ved bruk av MR-analyser kan vi måle effekten av medisinen direkte i pasienter, sier postdoktor Siver A. Moestue ved NTNU som er førsteforfatter av den publiserte artikkelen.
Med MR (magnetisk resonans) kan man se om svulsten krymper en viss tid etter behandling. Man kan også måle hvor mye det er av et spesifikt stoff i svulsten kort tid etter startet behandling. PI3K signalveien kontrollerer deler av stoffskiftet vårt (også kalt energiomsetning og metabolisme) og overaktiviteten fører til et unormalt nivå av ulike stoffer i cellene.
– I musemodellen kunne vi påvise at stoffskiftet endret seg etter behandling med den nye medisinen, noe som viser at medisinen hadde effekt, sier Moestue.
Målingen av mengden av de ulike stoffene i svulsten kan derfor brukes som såkalte metabolske biomarkører for å avgjøre effekten av behandlingen i klinikken.
– Jeg tror at MR kan være et enkelt og godt verktøy for å måle effekten av disse medisinene. Slik kan vi være sikre på at vi har gitt riktig medisin til riktig pasient. Hvis vi ikke ser noen effekt av behandlingen kan vi raskt skifte til en forhåpentligvis bedre medisin, påpeker Moestue.
– Nå har vi funnet ut hvilke stoffer som kan fungere som biomarkører for behandlingseffekt. Da kan vi utvikle skreddersydde MR-metoder for å måle disse biomarkørene i pasienter, legger Moestue til.
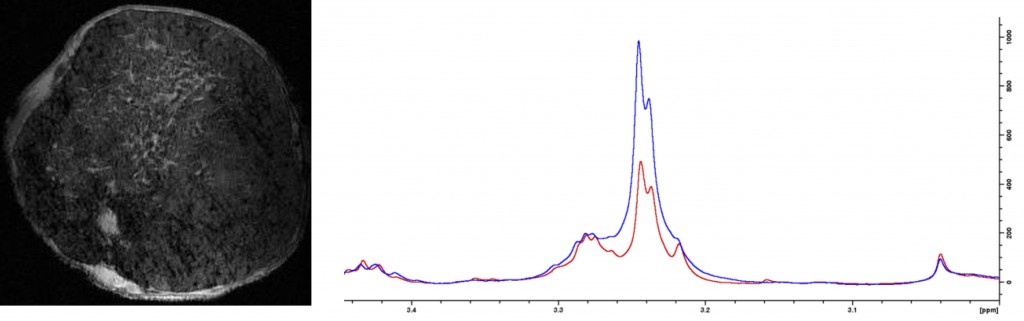
Til venstre ses et MR-bilde av et tverrsnitt gjennom en kreftsvulst i brystet til en forsøksmus. Til høyre ses et såkalt spekter som er dannet ut i fra MR-bildet. Det røde spekteret viser mengden av et stoff i metabolismen før behandling. Det blå spekteret viser at mengden av stoffet har økt etter behandling og at medisinen har effekt. Foto: Siver A. Moestue.
Kliniske studier
Den kvantitative billedanalysen er en metodikk som kan testes for bruk i rutinelaboratorier ved sykehus umiddelbart og kan brukes til svært mange ulike analyser. MR vet vi at allerede er en etablert metodikk i klinikken.
– For å kunne bruke akkurat denne metodikken for pasienter med basal-lignende brystkreft er vi derimot avhengige av å kjøre kliniske studier først, og de håper jeg vi kan komme i gang med allerede til høsten, sier Bjørkøy.
– Jeg er fasinert over at grunnforskningen som jeg har vært en del av nå har kommet så nær klinikken. Vi var langt fra hverandre da jeg begynte min forskerkarriere for tjue år siden, sier Bjørkøy.
Samarbeid på tvers av fagfelt og institusjoner
– Det har vært veldig interessant å samarbeide med forskere som er spesialister på helt andre felt enn meg selv. Dette er synergi på sitt beste og ingen av oss kunne gjort dette alene, påpeker Bjørkøy.
Selv er han eksperten på kvantifiserende billedanalyse, mens Moestue er MR-eksperten. De har derimot vært helt avhengige av samarbeidet med brystkreftekspertene ved Oslo universitetssykehus som har bidratt med musemodellene, pasientprøvene og massevis av kunnskap.
– Dette samarbeidet kan vi alle takke professor Ingrid S. Gribbestad ved NTNU for. Hun hadde alltid stor tro på gode samarbeidsprosjekter og fikk i gang dette prosjektet, avslutter Bjørkøy og Moestue nesten i kor.
Les også om andre forskningsprosjekter Kreftforeningen støtter.
Referanse
Metabolic biomarkers for response to PI3K inhibition in basal-like breast cancer. Moestue SA, Dam CG, Gorad SS, Kristian A, Bofin A, Mælandsmo GM, Engebråten O, Gribbestad IS, Bjørkøy G. Breast Cancer Res. 2013 Feb 28;15(1):R16. [Epub ahead of print]