Blogger: Ida Johansson
Phd- student ved Institutt for laboratoriemedisin, barne- og kvinnesykdommer (LBK) /Senter for Molekylær Inflammasjonsforskning (SFF-CEMIR)
Risikoen for å utvikle ulike sykdommer øker etter hvert som vi blir eldre. Om, og når, vi utvikler sykdom bestemmes både av arv og miljø. I motsetning til arvelige faktorer kan ulike miljøfaktorer i stor grad påvirkes. Kosthold er en sentral komponent i vårt miljø, og har vist å påvirke både aldring og sykdomsutvikling. Et kosthold rikt på flerumettede omega-3 fettsyrer fra fet fisk og annen sjømat antas å redusere risikoen for mange ulike sykdommer, inkludert kreft og hjerte-kar-sykdommer.
Flere cellulære mekanismer for disse gunstige sykdomsforebyggende effektene har vært foreslått og disse kan være forskjellige for ulike sykdommer, vev og celler. Felles for flere av de sykdommene som rammer oss når vi blir eldre er at ødelagte proteiner hoper seg opp inni og rundt cellene i det syke vevet, noe som vil skade disse cellene og bidra til sykdomsutvikling.

Flerumettede omega-3 fettsyrer kan hjelpe cellene til å kvitte seg med fjerne skadelige proteiner og minske nivået av skadelige, oksygenholdige forbindelser. Illustrasjonsbilde: iStock
Vår forskningsgruppe har nylig publisert en artikkel i tidsskriftet Autophagy der vi viser at flerumettede omega-3 fettsyrer aktiverer cellenes evne til å fjerne ødelagte og skadelige proteiner. I tillegg fant vi at slike fettsyrer aktiverer en sentral mekanisme i cellene som gjør at nivået av skadelige, oksygenholdige forbindelser går ned. Dette er oksygenholdige forbindelser som dannes som naturlige biprodukter av cellers metabolisme, og som kan forårsake mye skade inni cellene hvis nivået av dem blir for høyt. At flerumettede omega-3 fettsyrer reduserer forekomsten av slike ugunstige forbindelser i cellene i tillegg til at de aktiverer cellenes evne til å fjerne ødelagte og skadelige proteiner har ikke vært kjent før, og dette gir oss en økt forståelse for hvordan enkeltkomponenter i kostholdet vårt kan bidra til å forebygge sykdom.
Skadelige oksygenforbindelser kan gi sykdom
Som et resultat av cellers kontinuerlige oksygenforbruk og energiproduksjon vil det hele tiden dannes oksygenholdige, svært reaktive forbindelser i kroppen vår. Disse er skadelige for mange ulike deler av cellene; eksempelvis kan arvestoffet vårt skades, organeller inni cellene kan ødelegges eller ulike proteiner kan slutte å virke som de skal. Det danner seg altså «søppel» inne i cellene, og dersom disse ødelagte cellekomponentene ikke fjernes kan det føre til ytterligere skader inne i cellen og etter hvert sykdomsutvikling. For såkalte «neurodegenerative sykdommer» vet vi at det ved økende alder akkumuleres slike «søppelproteiner» og at nervecellene til slutt dør. Eksempler på slike sykdommer er Alzheimers og såkalt aldersbetinget makuladegenerering (AMD), som er en sykdom som gir betydelig synstap hos mange eldre. Ettersom befolkningen stadig blir eldre blir aldersassosierte sykdommer også mer vanlige. Komponenter som blir ødelagt kan heldigvis gjenkjennes, brytes ned og byttes ut i cellene, men denne evnen reduseres med alder. Det er derfor av stor interesse å forstå årsakene til slike sykdommer. Det vil øke våre muligheter for å forebygge at de i det hele tatt oppstår.
Aldersbetinget makuladegenerering (AMD) er den mest utbredte øyesykdommen i den vestlige verden, og den vanligste årsaken til sterkt redusert syn hos eldre. Det finnes per i dag ingen behandling som kurerer denne sykdommen. Utviklingen av AMD er i tidlig fase karakterisert ved opphopning av ødelagte proteiner og «proteinklumper» (aggregater) inni og rundt noen celler som ligger som et tynt cellelag under fotoreseptorene i øyet. Cellene i dette cellelaget kalles retinal pigment epitel (RPE)-celler og er nødvendige for at fotoreseptorene skal leve. Ved sykdommen AMD ser det ut til at ødelagte cellekomponenter i RPE-cellene ikke fjernes godt nok, noe som fører til at disse cellene blir syke og dør. Dette fører i neste omgang til at også fotoreseptorcellene på toppen av disse RPE-cellene dør. Etter hvert som flere fotoreseptorceller forsvinner vil synet gradvis svekkes. Epidemiologiske studier har indikert at et kosthold rikt på flerumettede omega-3 fettsyrer reduserer risikoen for å utvikle AMD. Vi var derfor interesserte i å undersøke om slike fettsyrer kunne påvirke de tidlige fasene av AMD ved å studere prosesser som skjer i RPE cellene der sykdommen starter.
Omega-3 fettsyrer minker skadelige oksygenforbindelser og aktiverer cellenes «søppelhåndteringsprosess»
I artikkelen publisert i tidsskriftet Autophagy viser vi at celler som blir gitt flerumettede omega-3 fettsyrer faktisk får en stress-reaksjon hvor produksjonen av reaktive oksygenforbindelser øker. Reaksjonen er av mild og forbigående karakter. Det interessante er at cellene i etterkant har fått en bedre evne til å redusere nivåene av de reaktive oksygenforbindelsene samtidig som deres evne til å fjerne ødelagte «søppelproteiner» er effektivisert, ved en prosess som kalles autofagi. Summen av dette innebærer at ødeleggelsen av proteiner og andre viktige bestanddeler av cellene blir redusert (søppelproduksjonen går ned). I tillegg stimuleres elimineringen av allerede skadde proteiner (cellene tar en ekstra ryddesjau).
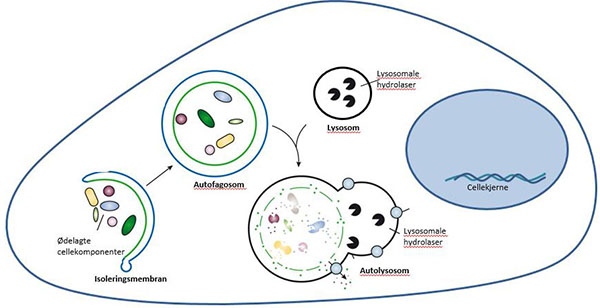
Skjematisk fremstilling av autofagiprosessen. Figuren er modifisert fra: Mizushima, N., B. Levine, A.M. Cuervo, and D.J. Klionsky, Autophagy fights disease through cellular self-digestion. Nature, 2008. 451(7182): p. 1069-75.
Autofagi (gresk for «selvspising») kan enkelt forklares som cellenes søppelhåndteringssystem: Cellen bryter ned sitt eget avfall og resirkulerer det nedbrutte materialet til nye byggesteiner og energi. Denne prosessen skjer normalt i alle celler i kroppen ved at søppelet gjenkjennes av spesielle proteiner i cellene som deretter samler søppelet sammen i klumper (aggregater) slik at det enklere kan omsluttes av en membran inne i cellene. Denne isolerte «søppelposen» fraktes videre til avfallsanlegget i cellene hvor det brytes ned i mindre bestanddeler som cellene kan benytte seg av. Å bli kvitt søppelet inne i cellene er viktig for kroppen, og vil kunne være avgjørende for om man utvikler sykdom eller ikke. Studier i dyremodeller der viktige gener for autofagi er fjernet, og som dermed ikke er i stand til å gjennomføre søppelhåndteringen, har vist at slike dyr utvikler forskjellige typer aldersbetingede sykdommer i svært ung alder. For flere av de aldersbetingede sykdommene hvor flerumettede omega-3 fettsyrer er foreslått å være gunstig har slike dyremodeller vist at fungerende autofagi er viktig for å unngå disse sykdommene. Det antas derfor at økt autofagi, eller søppelhåndtering, virker sykdomsforebyggende.
Videre studier: Effekter av omega-3 fettsyrer i ulike pasientgrupper med kroniske betennelser
Vi følger nå opp funnene ved å studere om disse beskyttelsesmekanismene, aktivert av flerumettede omega-3 fettsyrer, også er involvert i andre celletyper som er viktig i tidlige faser av sykdomsutvikling. Celler som styrer immunforsvaret er særlig interessante for tilstander som skyldes kroniske betennelsesreaksjoner. Vi håper at våre funn skal åpne for en bedre forståelse for hvordan enkeltkomponenter i kostholdet vårt, som omega-3 fettsyrer, påvirker vår helse over tid. Med økt mekanistisk forståelse håper vi at vi også kan forstå hvordan vi best mulig kan utløse gunstige helseeffekter. Overraskende fant vi for eksempel at antioksidanter tilsatt sammen med omega-3 fettsyrer motvirket noe av de antatt positive effektene av fettsyrene. Denne observasjonen kan få betydning for hvordan vi bør innta slike fettsyrer siden nivået av tilsatte antioksidanter varierer for ulike omega-3-produkter på markedet. Vi ønsker nå å følge opp disse funnene med studier av effektene av omega-3 fettsyrer i ulike pasientgrupper med kroniske betennelser.
Referanse
Ida Johansson; Vivi Talstad Monsena; Kristine Pettersen; Jennifer Mildenberger; Kristine Misundde; Kai Kaarniranta; Svanhild Schønberg og Geir Bjørkøy (2015): The marine n-3 PUFA DThHA evokes cytoprotection against oxidative stress and protein misfolding by inducing autophagy and NFE2L2 in human retinal pigment epithelial cells . Autophagy . Vol 11. Issue 9.

